Il bilanciamento delle reazioni redox permette di capire al meglio ciò che avviene durante i processi del metabolismo cellulare.
La mia (spero esauriente) spiegazione sul metabolismo cellulare ha introdotto diversi concetti, fra i quali troviamo anche le temute reazioni di ossidoriduzione. Siccome finora le ho spiegate in breve, ho deciso questo sarà l’argomento del ripasso di oggi.
In questo nuovo capitolo dedicato alla biologia e alla bioenergetica ci sarà quindi anche un po’ di chimica.
Dimentica i problemi delle ripetizioni tradizionali! Con noi ottieni un’esperienza unica e innovativa!
- Docenti qualificati: Scegliamo accuratamente i docenti per ogni materia e te li mettiamo a disposizione in meno di 24h 💯
- Flessibilità: Scegli quante lezioni fare, dove farle e quando farle. Personalizziamo il programma in base alle tue esigenze 🤸
- Didattica Digitale: La nostra piattaforma digitale è progettata per rendere l’apprendimento coinvolgente ed efficace 🚀
Nella prima parte dell’articolo capiremo l’ossidoriduzione nell’ambito del metabolismo cellulare, scoprendo cos’è, come avviene e soprattutto a cosa serve; nella seconda parte affronteremo invece l’ossidoriduzione dal punto di vista chimico, scoprendo proprio come si bilancia una reazione redox.
Cos’è l’ossidoriduzione: come funzionano le redox
Te l’ho detto che partivo dall’inizio: voglio che tutti questi concetti di base ti siano chiari così da darti le basi per comprendere – più avanti – le diverse vie metaboliche, dalla glicolisi alla fermentazione.
Bene, quindi cos’è l’ossidoriduzione o reazione redox? Si tratta di una particolare reazione chimica che avviene fra due composti:
- L’agente riducente
- L’agente ossidante
➡️L’agente riducente è l’elemento che si ossida, ovvero che perde uno o più elettroni, quindi il suo numero di ossidazione (n.o.) aumenta.
➡️L’agente ossidante è invece l’elemento che si riduce, ovvero che acquista uno o più elettroni, quindi il suo numero di ossidazione (n.o.) diminuisce
Per semplificare, nell’ambito del metabolismo cellulare, invece che pensare all’acquisto o alla perdita di elettroni, possiamo pensare in termini di idrogeno. Ecco che quando un composto (o molecola) si ossida significa che ha perso atomi di idrogeno. Se si riduce, al contrario, significa che ha acquisito atomi di idrogeno.
Spero di non averti perso 😂, perché la presenza di idrogeno/elettroni è di fondamentale importanza all’interno del metabolismo energetico della cellula: tanto più una molecola è ridotta (e quindi ha al suo interno uno o più atomi di idrogeno), maggiore è l’energia che racchiude al suo interno, o meglio fra i legami che la compongono.
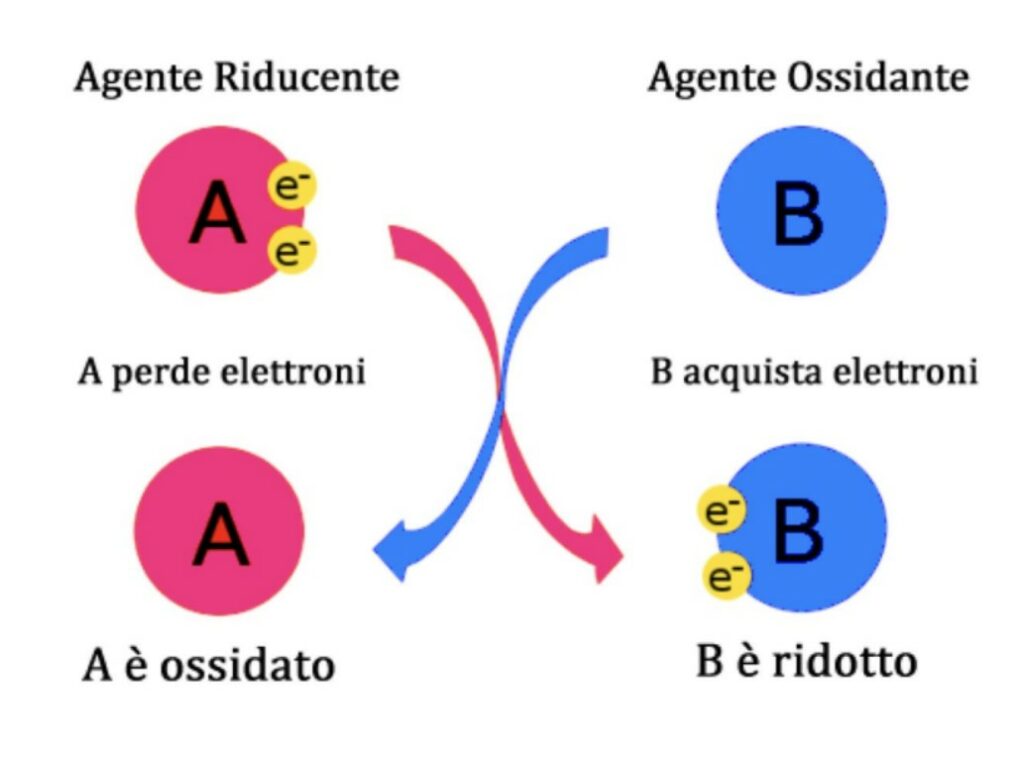
L’immagine qui di fianco farà capire meglio come funziona l’ossidoriduzione: le lettere A e B identificano, rispettivamente, l’agente riducente e l’agente ossidante. A si ossida e perde elettroni: questi elettroni vengono ceduti all’agente ossidante B che, riducendosi, acquista elettroni e immagazzina energia.
📎Schemino per ricordare meglio le reazioni di ossidoriduzione:
- Se una molecola ha tanti atomi di idrogeno è ridotta e ha molta energia immagazzinata nei suoi legami
- Se una molecola non ha atomi di idrogeno è ossidata e per questo ha liberato energia spezzando gli atomi di idrogeno contenuti al suo interno
Dimentica i problemi delle ripetizioni tradizionali! Con noi ottieni un’esperienza unica e innovativa!
- Docenti qualificati: Scegliamo accuratamente i docenti per ogni materia e te li mettiamo a disposizione in meno di 24h 💯
- Flessibilità: Scegli quante lezioni fare, dove farle e quando farle. Personalizziamo il programma in base alle tue esigenze 🤸
- Didattica Digitale: La nostra piattaforma digitale è progettata per rendere l’apprendimento coinvolgente ed efficace 🚀
I coenzimi coinvolti nelle reazioni redox nel metabolismo cellulare
Passiamo al livello successivo 🆙 facendo la conoscenza dei coenzimi coinvolti nelle reazioni di ossidoriduzione. Si tratta di molecole organiche che, lavorando in sinergia con un enzima, permettono le reazioni chimiche. Nell’ambito delle reazioni redox relative al metabolismo cellulare, i coenzimi coinvolti sono:
- il coenzima NAD, ovvero il nicotinammide adenin dinucleotide
- il coenzima FAD, ovvero il flavin adenin dinucleotide
Questi coenzimi possono presentarsi in forma ossidata o ridotta. Sono molto buona 😇, e per questo ti ho fatto una mini tabella per farti capire meglio:
| Nome coenzima | Forma ossidata | Forma ridotta |
| Coenzima NAD | NAD+ | NADH + H+ |
| Coenzima FAD | FAD+ | FADH2 |
Ricordo che le forme ossidate hanno minore energia, al contrario delle forme ridotte che sono ricche di energia a causa dei legami rappresentati dagli atomi di idrogeno che contengono al loro interno.
Come starai già immaginando, questi coenzimi hanno la capacità di passare da uno stato ridotto a uno stato ossidato a seconda delle necessità. Se un elemento si ossida, contemporaneamente un altro elemento viene ridotto ed entrambi i prodotti non rimangono ossidati o ridotti per sempre, ma possono tornare alla forma “originaria” grazie al passaggio di elettroni/atomi di idrogeno.
Ricordiamo quindi che ogni ossidazione è accompagnata dalla corrispondente riduzione ed è per questo, fondamentalmente, che l’ossidoriduzione si chiama così! Ecco perché, infine, una reazione di ossidoriduzione si può leggere sia da destra verso sinistra che da sinistra verso destra.
Un esempio di ossidoriduzione con il glucosio
Ok, ma qual è la molecola da cui si parte per dare avvio alle reazioni di ossidoriduzione nel metabolismo cellulare? Ebbene, la maggior parte delle volte si tratta del glucosio, che è la sostanza organica che, proprio attraverso le reazioni redox, produce energia sotto forma di ATP, ovvero l’adenosina trifosfato.
➡️ Per un ripasso sul tema (e per non allungare troppo questo articolo) ti consiglio di andare a leggerti la spiegazione sull’ATP, ovvero la vera e propria moneta energetica del metabolismo cellulare.
Ma torniamo al glucosio, che contiene ben 12 atomi di idrogeno: in presenza di ossigeno (l’agente ossidante), il glucosio si ossida e perde elettroni trasformandosi in anidride carbonica (che non ha più atomi di idrogeno).
Ma ricordiamo che se c’è una specie chimica che si ossida, ce n’è un’altra che si riduce perché ossidazione e riduzione avvengono contemporaneamente, E a ridursi è proprio l’ossigeno che quindi acquista atomi di idrogeno e diventa acqua liberando energia sotto forma di ATP.
Queste reazioni di ossidoriduzione, che trovano nel glucosio il loro motore, sono quelle che ad esempio avvengono nella glicolisi e nella respirazione cellulare, che ha il suo culmine nella fosforilazione, che produce moltissima energia sotto forma di ATP.

Bilanciare le reazioni redox
Ok, ma come bilanciare una redox? 😭 Non preoccuparti, perché ora ho spiegato a grandi linee le regole dell’ossidoriduzione possiamo passare al paragrafo che fa tremare le gambe anche ai tavoli: il bilanciamento delle redox! Non andare a nasconderti, giuro che proverò a spiegarti il tutto nel modo più semplice possibile.
Come macrotema, qui si passa dalla biologia/bionenergetica alla chimica. Ma ti assicuro che questo paragrafetto ti sarà molto utile anche per capire meglio come funziona il metabolismo cellulare.
Le coppie redox e le semireazioni
Per capire meglio il bilanciamento delle redox partiamo al concetto di coppia redox, perché all’interno di ogni reazione di ossidoriduzione si possono appunto individuare queste coppie. Prendiamo ad esempio questa reazione redox:
Zn + Cu2+ → Zn2+ + Cu
In questa reazione lo zinco si ossida acquisendo due elettroni, mentre il rame si riduce perdendoli. Per evidenziare il trasferimento di elettroni si divide l’equazione chimica dell’ossidoriduzione in due semireazioni:
- Semireazione di ossidazione: Zn → Zn2+ + 2e-
Lo zinco, da forma atomica passa da forma ionica e cede due elettroni
- Semireazione di riduzione: Cu2+ + 2e- → Cu
Il rame in forma ionica acquista i due elettroni dello zinco trasformandosi in rame in forma atomica.
In questo modo abbiamo evidenziato la semireazione di ossidazione (cessione degli elettroni) e la semi reazione di riduzione (acquisizione di due elettroni). In queste reazioni, come dice la definizione stessa di ossidoriduzione, avviene un cambio nel numero di ossidazione della specie coinvolta. Quindi:
- Con l’ossidazione aumenta il numero di ossidazione
- Con la riduzione diminuisce il numero di ossidazione
Ed ecco che abbiamo individuato le coppie redox 🎉, che differiscono appunto per il numero di ossidazione:
- Zn/Zn2+
- Cu2+/Cu
Individuare queste coppie ci permette di identificare quanti elettroni sono stati coinvolti nelle reazioni redox, e questo ci darà un grandissimo vantaggio quando ci toccherà bilanciarle!
Dimentica i problemi delle ripetizioni tradizionali! Con noi ottieni un’esperienza unica e innovativa!
- Docenti qualificati: Scegliamo accuratamente i docenti per ogni materia e te li mettiamo a disposizione in meno di 24h 💯
- Flessibilità: Scegli quante lezioni fare, dove farle e quando farle. Personalizziamo il programma in base alle tue esigenze 🤸
- Didattica Digitale: La nostra piattaforma digitale è progettata per rendere l’apprendimento coinvolgente ed efficace 🚀
Come bilanciare le reazioni redox
Inizio col dire che esistono tantissimi modi per bilanciare le reazioni di ossidoriduzione ma, se si conosce il numero di ossidazione, il metodo della variazione dei numeri di ossidazione consente di andare molto più velocemente (soprattutto qualora tu ti stia preparando per il test d’ingresso!)
🆙Ricorda che il numero di ossidazione cambia a seconda della molecola in cui il singolo atomo di trova!
Ecco gli step da seguire illustrati qui sotto su una specifica reazione di ossidoriduzione:
1. Si assegnano i numeri di ossidazione agli atomi coinvolti nella reazione.
In questa reazione illustrata qui sotto sono coinvolti, in ordine di apparizione: l’acido solfidrico e l’acido nitrico, che producono zolfo, monossido di azoto e acqua. In questa formula abbiamo quindi assegnato i numeri di ossidazione ad ogni elemento.
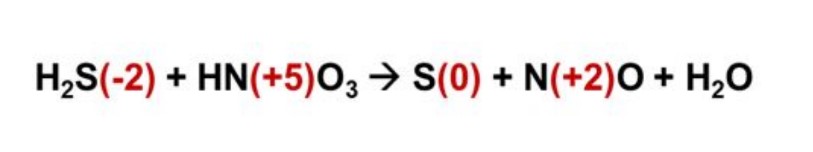
- Il numero di ossidazione dello zolfo all’interno della molecola di acido solfidrico è -2
- Il numero di ossidazione dell’azoto nella molecola dell’acido nitrico è +5
- Il numero di ossidazione dello zolfo in forma atomica è 0
- Il numero di ossidazione dell’azoto nel monossido di azoto è +2
2. Si individuano le coppie redox, capendo la specie che si ossida quella che si riduce, collegando entrambe le coppie con le frecce
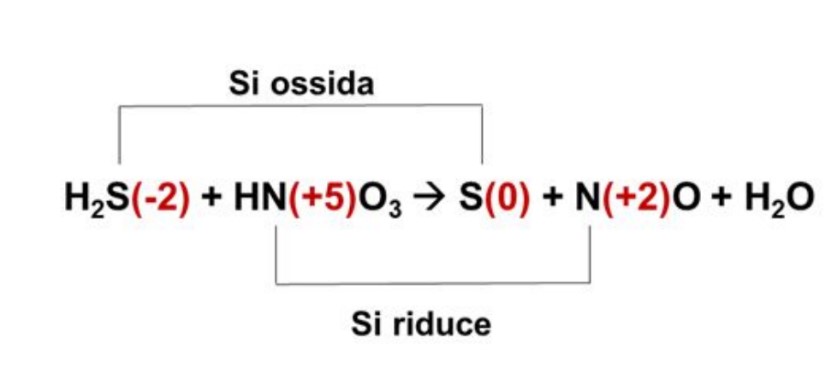
3. A questo punto, sulle frecce, si scrivono quanti sono gli elettroni acquisiti o ceduti, ovvero la differenza fra questi all’interno della coppia redox. Nella sopracitata formula:
- Lo zolfo aumenta il suo numero di ossidazione (passa da – 2 a 0), quindi si ossida acquisendo 2 elettroni
- L’azoto diminuisce il suo numero di elettroni (passa da 5 a +2), quindi si riduce perdendo 3 elettroni
4. A questo punto si moltiplica il numero di elettroni scambiati (acquisiti o persi) per i coefficienti, ovvero il minimo comun denominatore fra gli elettroni acquisiti dallo zolfo e quelli persi dall’azoto.
In questo caso i numeri di elettroni acquisiti e persi sono rispettivamente sono 2 e 3: il minimo comun denominatore fra questi due numeri è 6.
Ora bisogna individuare dei fattori che, moltiplicati per 2 (relativo all’ossidazione) e 3 (relativo riduzione), diano come risultato 6. Rispettivamente si tratta dei fattori 3 e 2, come evidenziato qui sotto.
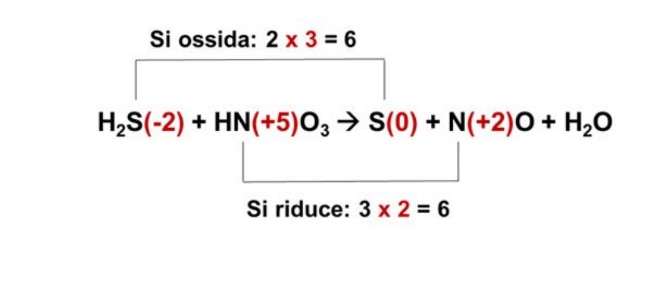
Quindi
- 3 è il fattore stechiometrico da prendere in considerazione nel caso dell’ossidazione.
- 2 è il fattore stechiometrico da prendere in considerazione nel caso della riduzione
5. A questo punto si assegnano i fattori stechiometrici all’agente ossidante e all’agente riducente in modo da rendere uguale il numero degli elettroni ceduti e quello degli elettroni acquisiti. Scritto nella formula, risulterà così:
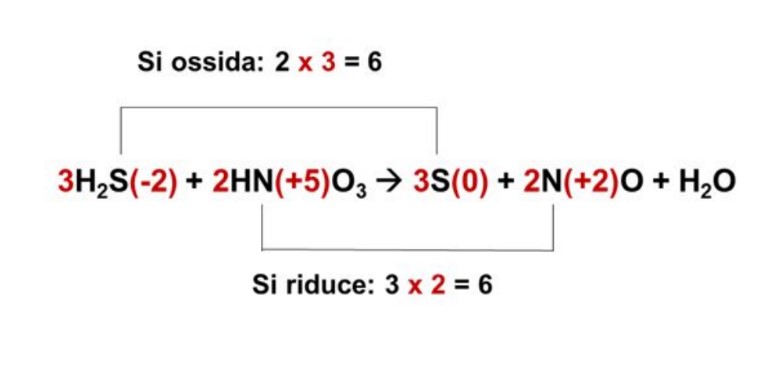
6. Infine si bilancia in modo definitivo la reazione chimica in accordo con la legge di Lavoisier, andando a bilanciare anche le masse degli atomi che non partecipano direttamente alla reazione di ossidoriduzione.
Infatti, mettendo semplicemente i fattori stechiometrici di fronte alle molecole che si sono ossidate e ridotte e facendo la conta degli atomi di ossigeno e idrogeno all’interno della reazione nell’immagine qui sopra, questi ultimi non sarebbero uguali. In particolare:
- Nei reagenti, gli atomi di idrogeno sono 8, e ossigeno sono 6
- Nei prodotti gli atomi di ossigeno sono 3, e gli atomi di l’idrogeno sono 2.
È quindi necessario bilanciare anche la molecola dell’acqua, mettendo semplicemente il numero 4 davanti alla molecola dell’acqua, come illustrato qui sotto.
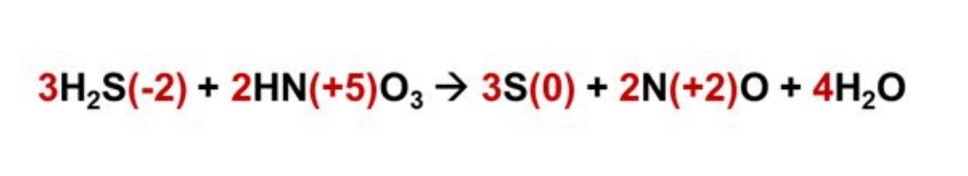
Amici, è tempo di stappare lo champagne, la reazione di ossidoriduzione è finalmente bilanciata! 🍾
Ossidoriduzione in ambienti acidi e basici
Purtroppo non finisce qui 🥵 Le reazioni di ossidoriduzione in soluzione acquosa coinvolgono anche gli ioni H+ e ioni OH−, che partecipano allo scambio di elettroni influenzando tutto il processo.
Ne consegue che, per bilanciare correttamente una reazione redox di questo tipo, è necessario specificare in che tipo di ambiente si opera, ovvero se è basico o acido. Come procedere?
- In entrambi i casi scriviamo l’equazione redox non bilanciata e separiamo i reagenti che si ossidano da quelli che si riducono.
- Dopo, tracciamo le semireazioni di ossidazione e di riduzione ed equilibriamo il numero di atomi e di cariche.
A questo punto moltiplichiamo ogni semireazione per un fattore in modo che il numero di elettroni ceduti sia uguale al numero di elettroni ricevuti. - Sommando le due semireazioni moltiplicate insieme (ed eliminando gli elettroni) possiamo controllare che la carica sia bilanciata e che il numero di atomi sia uguale.
➡️ In ambiente acido, possiamo:
- aggiungere ioni H+ in modo da bilanciare il numero di atomi di idrogeno;
- aggiungere ioni OH– in modo da bilanciare gli ioni H+ e formare acqua.
➡️ In ambiente basico, possiamo:
- aggiungere ioni OH– in modo da bilanciare gli ioni H+ presenti nell’equazione e formare acqua;
- controllare che gli ioni H+ e gli ioni OH– siano bilanciati e aggiungere altri per equilibrare.
Siamo finalmente giunti alla fine! Doppio brindisi! 🍻🍻
Spero davvero che questa spiegazione completa sulle reazioni di ossidoriduzione possa esserti utile per capire meglio la chimica, ma anche il metabolismo cellulare in biologia.
Nei prossimi episodi entriamo nel vivo e trattiamo i processi che seguono la produzione e il consumo di ATP. Infatti, incontreremo la glicolisi e i suoi prodotti, la respirazione cellulare con il ciclo di Krebs e molto altro ancora. Non stai nella pelle, vero?
Ricorda, inoltre, che se vuoi ripassare in modo approfondito tutti gli argomenti connessi alla branca della biologia puoi affidarti a Futura, che ti mette a disposizione spiegazioni complete, esercizi e ripetizioni mirate.
In più, se durante lo studio ti sorgono dubbi o domande, non esitare a chiedere spiegazioni o consigli. Unisciti alla nostra pagina Instagram per confrontati con gli altri studenti su qualsiasi altra materia! 💬